Genetyka świnek morskich
Na umaszczenia świnek morskich wpływa wiele różnych genów, które odpowiedzialne są za:
Podstawowymi pigmentami włosa świnek morskich są pigmenty czerwony i czarny. To z nich powstaje większość innych barw.
- kolory
- intensywność kolorów
- rozmieszczenie kolorów
- ilość barw zwierzęcia
geny z grupy b
W zasadzie określenie “pigment czarny” powinno być zastąpione przez “pigment ciemny“, gdyż zwierzę może posiadać pigment czarny lub czekoladowy, lecz nigdy obydwa naraz. Ten ciemny pigment posiadają prawie wszystkie świnki, również te, u których nie widać go w fenotypie.
O tym czy pigment ciemny u świnki będzie czarny czy czekoladowy, decydują geny z Grupy B. Dominującym genem jest tu faktor B, determinujący tworzenie czarnego pigmentu.
Gen recesywny b decyduje o wytworzeniu czarnego pigmentu. Oznacza to, że świnka posiadająca czarny pigment może być zarówno BB, jak i Bb. Jeśli świnka posiada pigment czekoladowy, to zawsze jest bb. Warto wspomnieć, że genotyp bb jest silnie pożądany w przypadku wszystkich jasnych odcieni czerwonego: kremowy, szafran, buff, złoty – kiedy zależy nam na dużej jasności barwy. Jednak sam czerwony jest wyjątkiem, gdyż w tym wypadku pożądana jest jak największa intensywność koloru, czyli genotyp BB. W przypadku świnek czarnych o genotypie Bb, głębia koloru jest mniejsza niż w przypadku świnki o genotypie BB. Jest to spowodowane tym, że o ile w przypadku genotypu BB produkowana jest maksymalna ilość pigmentu, to w przypadku Bb produkowany jest zarówno pigment czarny jak i czekoladowy. Czekoladowy jest przykryty pigmentem czarnym i nie jest widoczny.
geny z grupy E
Samo wyprodukowanie czarnego pigmentu nie jest warunkiem wystarczającym na to, żeby świnka była czarna. Aby widzieć zwierzę czarne muszą być spełnione dwa warunki: wyprodukowanie czarnego pigmentu – gen B oraz całkowite i równomierne rozłożenie go po całym ciele – gen E. W tym miejscu musimy zaznaczyć, że każda czarna świnka posiada również czerwony pigment, który jest naturalnie rozłożony równomiernie po całym ciele, zaś pigment czarny “przykrywa” pigment czerwony. Zatem każde czarne zwierzę posiada oprócz pigmentu czarnego, również pigment czerwony, rozprowadzony pod spodem.
Gen ep z grupy E determinuje miejscowe rozłożenie czarnego pigmentu, w ten sposób, że zwierzę posiada czarne pola, na których pigment czerwony przykryty jest czarnym oraz pola czerwone, na których czarny pigment nie został dopuszczony. Świnka jest zatem podzielona na czarne i czerwone obszary – dokładnie w ten sposób powstaje umaszczenie szylkret (tortoiseshell, schildpatt). Gen ep Sprawia zatem, że kolor czarny i czerwony mogą być widoczne obok siebie na jednym zwierzęciu, poprzez miejscowe wyrugowanie z włosa pigmentu czarnego. Faktor ten jest recesywny względem E. Idąc dalej tym tropem możemy spodziewać się genu powodującego całkowite niedopuszczenie czarnego pigmentu do ujawnienia się. Tym genem jest e, który jest recesywny zarówno względem E jak i ep. Faktor e zapobiega ujawnieniu się ciemnego pigmentu we włosie, ale ten pigment jest cały czas obecny w skórze zwierzęcia! Jako, że w sierści nie ma czarnego barwnika, widoczne staje się to, co normalnie byłoby pod nim ukryte, czyli kolor czerwony. Dokładnie w taki sposób powstają zwierzęta o barwie czerwonej i wszystkich jej jaśniejszych odcieniach. Czarny pigment pozostaje jednak nieco widoczny na uszach i łapkach zwierzęcia.
W tym momencie istotne staje się dokładne poznanie całej hierarchii dominacji genów, gdyż tylko wtedy możemy prawidłowo przewidywać jakie umaszczenie będzie nosiło potomstwo. O ile w przypadku grupy B, hierarchia ta była jasna i fenotypy oczywiste, o tyle w grupie E mamy już więcej genów, przypomnijmy więc jakie mamy możliwości:
- EE, Eep, Ee – zwierzę czarne, w drugim przypadku może dać potomstwo szylkretowe, w trzecim czerwone; widać, że jeśli świnka posiada gen E, to niezależnie od tego, z czym jest on w parze, świnka będzie zawsze czarna
- epep, epe – szylkret, w drugim przypadku może dać potomstwo czerwone
- ee – świnka czerwona
Jeśli więc skrzyżujemy czyste genotypowo czarne zwierzę (EE) ze świnką czerwoną (ee), to otrzymamy potomstwo o genotypie Ee, czyli 100% czarnych, ponieważ E dominuje nad e. Jeśli jednak skrzyżowalibyśmy zwierzę czarne o genotypie Ee, z czerwoną świnką (ee), to dostaniemy 50% potomstwa czarnego i 50% czerwonego. Co zaś jeśli skrzyżujemy ze sobą dwie czarne świnki Ee?
E
e
E
EE
Ee
e
Ee
ee
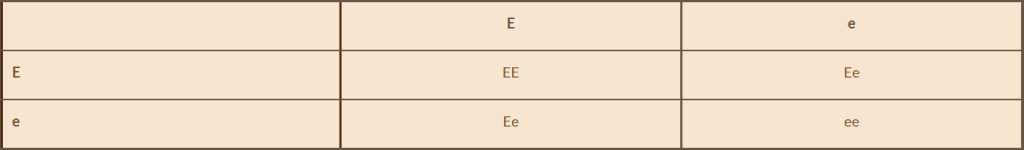
Oznacza to, że z dwóch czarnych zwierząt możemy mieć 25% szans na otrzymanie czerwonej świnki.
Znane jest też czerwono-czarne umaszczenie zwane brindle. O ile wartość szylkreta rośnie wraz ze stopniem rozdzielenia kolorów na ciele, o tyle brindle jest tym lepszy, im włosy czarne są bardziej przemieszane z włosami czerwonymi. To umaszczenie nie powstaje przez żaden gen z grupy E, jest determinowane przez geny, które nie są jeszcze poznane. W praktyce bardzo rzadko rodzą się prawdziwe brindle’e i szylkrety, najczęściej zwierzę posiada zarówno pola jednobarwne, jak i przesiania. Fotografie poszczególnych umaszczeń można znaleźć w artykule Rasy i Umaszczenia.
Cecha agouti polega na tym, że środkowa 1/3 każdego włosa na ciele pozbawiona jest czarnego pigmentu, tak że ukryta pod spodem barwa staje się widoczna. Dla pigmentu czarnego i czerwonego, umaszczenie to nosi nazwę złotego agouti.
Widać zatem, że aby cecha agouti była widoczna, świnka musi posiadać we włosach czarny pigment. Oznacza to, że na czerwonym włosie (jak i na jaśniejszych wariantach czerwieni) cecha agouti nigdy nie jest widoczna. Nie oznacza to bynajmniej, że zwierzę nie jest agouti – jeśli posiada gen odpowiedzialny za pojawienie się tej cechy, to jest ono agouti i może przekazywać tę cechę dalej, mimo iż jej nie widać!
geny z grupy A
Gen odpowiedzialny za powstanie tego umaszczenia to A, który dominuje nad faktorem determinującym brak tej cechy – a. Jeśli zatem świnka jest ee, to niezależnie od tego, czy posiada gen agouti, czy też nie – nie będzie ta cecha widoczna w fenotypie. Nie możemy w tym przypadku powiedzieć, że kombinacja ee dominuje nad A, gdyż pojęcie dominacji nie wychodzi poza różne allele tego samego genu. Mamy tu do czynienia ze zjawiskiem epistazy.
Epistaza to nieujawnienie się danej cechy fenotypowej spowodowane obecnością określonego allelu innego genu. W przypadku AA epep , czyli szylkret agouti, mamy zatem umaszczenie czerwony-złoty agouti.
Charakterystyczny dla umaszczenia agouti jest brzuch takiej świnki. Do wysokości 1/3 od nasady włosa na brzuchu jest on barwiony pigmentem ciemnym, dalej zaś barwnik ten nie jest dopuszczony. U złotego agouti oznacza to, że brzuch jest czerwony, jeśli jednak przejechalibyśmy po nim ręką pod włos, to okazałoby się, że włosy te są u nasady czarne. Jeśli brzuch świnki ma taki sam wygląd jak wierzch, czyli agouti, to umaszczenie to nazywa się solid agouti. Ten fenotyp determinowany jest genem ar, który jest recesywny względem A i dominujący nad a. Powoduje on pojawienie się cechy agouti również na brzuchu zwierzęcia.
Jak zatem będzie wyglądało zwierzę o genotypie arar epep ? Podobnie jak czerwony-złoty agouti, z tą tylko różnicą, że cecha agouti będzie pojawiała się również plackami na brzuchu. To umaszczenie nazywamy czerwony-złoty solid (agouti).
Dlaczego? Ponieważ na czarnych polach ujawnia się cecha agouti – pokazuje się czerwony barwnik na środkowej 1/3 włosa, zaś czerwone pola pozbawione są czarnego barwnika, a zatem cecha agouti nie ujawnia się fenotypowo, czyli pola te pozostają czerwone.
Ostatnim genem z grupy A jest faktor at. Sprawia on, że zwierzę nosi cechy tan, otter, lux lub fox.
Umaszczenia te charakteryzują się tym, że włosy płaszcza świnki posiadają ciemny pigment, natomiast brzuch, okolice oczu, nosa i uszu pozbawione są tego pigmentu i przyjmują barwę pigmentu “ukrytego” pod ciemnym. Dla tan jest to czerwony lub złoty, dla lux – buff lub pomarańczowy, dla otter – kremowy i dla fox – kolor biały. Kolory na granicy płaszcza i brzucha są lekko przesiane. Gen at dominuje nad a, zachowuje się recesywnie względem A oraz ar. Przypuszcza się jednak (i wyniki hodowli na to wskazują), że ar dominuje w sposób niepełny nad at. Oznacza to, że świnki o genotypie arat nie są czystymi solid, lecz noszą też pewne cechy tan, otter, fox lub lux. Geny te zdają się sobie przeszkadzać i zwierzęcia nie można wtedy jednoznacznie zakwalifikować ani jako solid, ani jako tan. Podsumujmy zatem informacje dotyczące hierarchii dominacji w grupie A, niech posłuży temu następujące zestawienie:
- AA, Aar, Aat, Aa – świnka jest agouti, w drugim przypadku może dać potomstwo solid, w trzecim tan/lux/otter/fox, w czwartym bez aguti
- arar, arat, ara – solid agouti, w drugim przypadku niepełna dominacja, nosiciel cechy tan, w trzecim nosiciel bez-agouti
- atat, ata – świnka jest tan, otter, lux lub fox, w drugim przypadku nosiciel bez-agouti aa – świnka bez aguti
Geny agouti mogą też determinować jeszcze jedną cechę, a ściślej rzecz ujmując agouti ujawnia się inaczej w szczególnym przypadku. Kiedy świnka o genotypie A-, posiada również czerwone oczy, to włos jej nie dzieli się już na trzy części, lecz na dwie równe połowy, z których część przy nasadzie ma barwę z grupy czarnych, a część wierzchnia z grupy czerwonych. To umaszczenie nosi nazwę argente. Wyjątkiem jest złoty agouti, który nie przechodzi w argente, lecz w tzw. salm agouti, który ma włos lila przy nasadzie i na końcówce, a czerwony pośrodku.
geny z grupy P
Kolor oczu determinują geny z grupy p. Gen dominujący P odpowiada za czarną barwę oczu, recesywny wobec niego jest p, który nadaje oczom barwę czerwoną, lecz również rozjaśnia pigmenty barwiące włos! W ten sposób z pigmentu czarnego tworzy się lila, z czekoladowego – beż, a z czerwonego otrzymujemy gold p.E., czyli złoty czerwonooki. Z tego też powodu znakomita większość argente posiada spodnią barwę lila – dlatego, że posiadają czarny barwnik.
Oprócz genów P i p istnieje w grupie P także faktor pr, który jest mutacją genu p i determinuje kolor oczu rubinowy. Zwierzę takie rodzi się z oczami czerwonymi, które następnie ciemnieją z wiekiem do barwy rubinowej. Gen pr nie powoduje rozjaśnienia pigmentu czerwonego, pigment czekoladowy rozjaśnia się tylko nieznacznie, natomiast barwa czarna rozjaśnia się do slate blue, czyli stalowego, dymnego szarego. Kolor skóry może wahać się od cielistego do ciemnoszarego, jednak w hodowli najbardziej pożądane są zwierzęta zarówno z jak najciemniejszym pigmentem w skórze, jak i najciemniejszym kolorem oczu.
Znana jest też niebieska barwa oka oraz ciemnoczerwona, które wynikają z obecności pewnych genów z grupy C, ale o tym później.
geny z grupy S
Zanim przejdziemy do części najbardziej skomplikowanej, czyli tworzenia się rozrzedzonych pigmentów, omówimy powstawanie białych barw u świnek.
Białe pola w umaszczeniu świnek morskich są najczęściej determinowane genami z grupy S. Faktor dominujący S odpowiada za brak białych plam, zaś za ich powstawanie.
Geny w tej grupie w sposób niepełny/niepełnie dominują względem siebie. Genotyp SS oznacza teoretycznie brak jakichkolwiek białych obszarów, jednak w praktyce niewielkie białe pola mogą się ujawnić pomimo braku genów odpowiedzialnych za to. Przyjmuje się, że obszary te mogą statystycznie obejmować do 5% powierzchni ciała. Genotyp Ss, na skutek niepełnej dominacji powoduje pokrycie białymi plamami do 50% powierzchni ciała, ss zaś od 50 do 95%. Już na pierwszy rzut oka nasuwa się kilka wniosków.
Po pierwsze brak genu s nie zagwarantuje nam, że żadna biała plama nie ujawni się u potomstwa, jak również kombinacja ss nie zapewni nam nigdy w pełni białego zwierzęcia. Po drugie granice są podane dość orientacyjnie i czasem trudno na podstawie fenotypu określić genotyp. Hodowla świnek z białymi plamami musi zatem być dobrze przemyślana, a zwierzęta do rozmnożenia dobrze wybrane. Często takie hodowle opierają się właśnie na chowie selektywnym, a znajomość rodziców, jak i potomstwa są bardzo ważne. Należy także wiedzieć, że jeśli zwierzę biało-jednobarwne będzie na skutek swojego genotypu po połowie białe i jednobarwne, to w przypadku świnek biało-dwukolorowych (np. TSW, czyli szylkret z białym), te proporcje rozłożą się statystycznie po 1/3 na każdy kolor.
Nie zawsze jednak białe owłosienie powstaje poprzez geny z grupy S. Temat jednobarwnych białych świnek, jak i albinosów himalajskich pozostawmy sobie do omówienia przy okazji grupy C, teraz zajmijmy się innymi przykładami.
geny z grupy R
Bardzo charakterystyczną cechą umaszczenia jest dalmatian i roan. Te cechy warunkowane są obecnością genu dominującego Rn (niekiedy w literaturze oznaczany Rs), który może powodować miejscowe usunięcie wszystkich pigmentów z większości włosów na całym ciele oprócz głowy i nóg, co oznacza, że włosy stają się białe. Jeśli jest ich dużo, to możemy otrzymać dalmatiana, czyli świnkę o ciemnej głowie i nogach, która ma biały tułów z ciemnymi plamkami. Roan zaś charakteryzuje się tym, że włosów białych jest mniej i są one przesiane z ciemniejszym włosem – roan nigdy nie powoduje powstania “zwykłych” jednostajnych białych plam. Gen Rn powstał w wyniku mutacji i jest on letalny, co oznacza, że genotyp RnRn nie przeżywa. Dlatego też nie krzyżuje się nigdy dalmatian x dalmatian ani roan x roan. W wyniku tych krzyżówek mogą przyjść na świat całkowicie białe czerwonookie świnki o genotypie RnRn, zwane młodymi mikroptalmicznymi (ang. microphthalmic babies) od nazwy choroby – mikroptalmii – polegającej na znacznej redukcji lub w ogóle braku wykształconego oka. Ponadto u takich świnek mogą również nie wykształcić się kończyny. Zwierzęta takie rodzą się martwe lub umierają wkrótce po narodzinach. Aby zawsze dało się zauważyć nawet niewielkie przesiania, które wskazują na obecność genu Rn, powinno się unikać krzyżowania roanów z jasnymi świnkami. Reasumując:
- RnRn – młode mikroptalmiczne
- Rnrn – roan lub Dalmatian
- rnrn – to genotyp każdej świnki, która nie nosi cechy roan ani dalmatian
Aby otrzymywać jak najatrakcyjniejsze świnki o umaszczeniach roan i dalmation, najlepiej krzyżować roan/dalmatian ze świnką jednobarwną o barwie roana/dalmatiana, której jednym z rodziców był roan/dalmatian. Na przykładzie: jesteśmy hodowcami świnek o maści black dalmatian. Potomstwo otrzymujemy krzyżując black dalmatian x black (jednobarwna czarna świnka, której jedno z rodziców było black dalmatian). Młode czarne z tego miotu mają rodzica dalmatiana, więc nadają się idealnie do krzyżowania z kolejnymi dalmatianami. Podobnie jest w przypadku roanów. Krzyżujemy np. strawberry roan x jednobarwna czerwona świnka, której jednym z rodziców był roan.
W swej genezie gen Rn był genem cechy dalmatian i tylko niektórzy hodowcy wykorzystywali ten gen do otrzymywania przesiań typu roan. Cechę roan zaś otrzymywało się poprzez geny z grupy Si, które wcale nie były letalne. Za “roanowość” odpowiedzialny był gen recesywny Si. Zatem fenotypy ujawniały się następująco:
- SiSi – brak roan
- Sisi – mogą być niewielkie miejscowe przesiania, gdyż Si dominuje niepełnie nad Si
- sisi – roan
Z genami grupy Si skojarzone są geny Dm. Mają one swój wpływ na fenotyp jedynie w przypadku kombinacji sisidmdm, powodując fenotyp chorobliwie biały z jedynie niewielkimi kolorowymi plamkami. Jeśli jednak hodowca nie posiada w swojej hodowli genu dm, to może spokojnie krzyżować roan x roan. Dziś gen Si jest już właściwie zgubiony i niewielu hodowców hoduje te “prawdziwe” roany. Roany oparte na genie Rn nazywa się mock roans lub US roans.
Charakterystyczną cechą rasy american crested jest biała koronka na głowie. U tych świnek niedozwolony jest jakikolwiek inny włos w koronie, jak też żaden biały włos poza koroną. Biel korony nie może być determinowana genem s, gdyż nie ma on wpływu na rozmieszczenie białych plam, a zatem pojawiałyby się one w najróżniejszych częściach ciała. Geny odpowiedzialne za wytworzenie białej korony nie są jeszcze znane i american crested hodowane są przez selekcję, czyli do rozmnożenia wybierane są osobniki o najlepszej koronce.
Teraz, kiedy wiecie już prawie wszystko na temat genetyki świnek morskich, zapnijcie pasy, bo zbliżamy się do najciekawszego: grupy C.
geny z grupy C
Geny z tej serii powodują rozjaśnianie podstawowych pigmentów i to dzięki nim otrzymujemy barwy takie jak buff, szafran, kremowy, sepia, himalaya, czy biały. Geny w tej serii są cztery, w następującej hierarchii dominacji: C dominuje nad wszystkimi, powoduje maksymalne nasycenie barwy, cd jest recesywny tylko względem C, cr względem C i cd, zaś ca (oznaczany też czasem ch) jest recesywny względem wszystkich wyżej wymienionych.
Żeby bardziej skomplikować sprawę, geny te (oprócz C) są niepełnie dominujące i jeśli cdcd da nam np. szafran, to cdcr da krem. Dodatkowo, ta sama kombinacja może powodować niemal całkowite rozjaśnienie jednego pigmentu do bieli, inny pozostawiając niemal nie rozjaśnionym!
Aby już bardziej nie komplikować, postaram się wyjaśnić to jak najprościej – poprzez poniższą tabelkę, która przedstawia wpływ wszystkich kombinacji na poszczególne pigmenty.
czarny
czekoladowy
czerwony
agouti
CC, Ccd, Ccr,Cca
Czarny
Czekoladowy
Czerwony, złoty
Złoty
cdcd
Ciemna sepia (oczy czarne do rubinowych)
Buff, szafran
Szary
cdcr
Ciemna sepia (oczy czarne do rubinowych)
Kremowy
cdca
Jasna sepia (oczy czarne do rubinowych)
Kremowy (nieco jaśniejszy)
crcr
Ciemna sepia (oczy czarne do rubinowych)
Biały ciemnooki
Srebrny
crca
Jasna sepia (oczy czarne do rubinowych)
Biały ciemnooki
Srebrny
caca
Himalaya czarny
Himalaya czekoladowy
Biały czerwonooki
brak
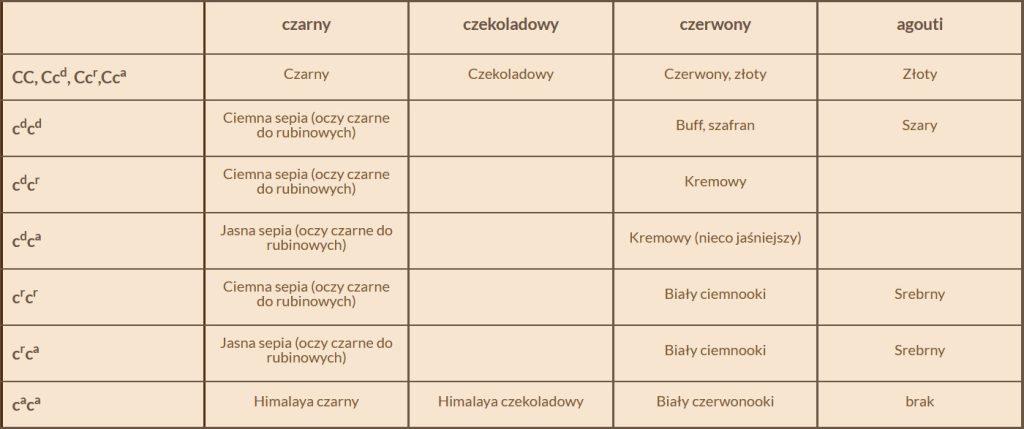
Tabelka wymaga niejakiego komentarza. Po pierwsze widzimy, że w palecie barw czarnych mamy kolor sepia.
Jaka to barwa?
Jest to kolor, który można określić jako nieco wyblakłą czerń lub ciemnoszary aż do jasnoszarego. U świnek trójkolorowych z kremem i bielą, trzeci kolor będzie to sepia – jasna lub ciemna. Takie właśnie umaszczenie ma np. Bandit, co jest spowodowane kombinacją cdcr lub cdca. Sepia nie jest uznana jako kolor w żadnym standardzie, zwykle traktuje się ją jako źle wybarwioną czerń.
Himalaye są bardzo ciekawym genetycznie przykładem. Przecież te zwierzęta są niemal całkowicie białe, mimo iż mogą mieć genotyp BB EE, czyli całkowicie czarnej świnki. Jednak geny ca powodują wyrugowanie niemal całego barwnika z ciała – pozostawiając jedynie niewielkie obszary pigmentu w miejscach najbardziej narażonych na zimno, tzw. plamki zimne. Zauważmy, że w przypadku pigmentu czerwonego zostaje on usunięty całkowicie – tak oto powstaje zwierzę całkowicie białe: poprzez kombinację ee caca.
Ponieważ tzw. albinosy lub PEW powstają poprzez działanie genu ca, odpowiedzialnego za cechę himalaya, stąd bierze się sformułowanie, że albinosów nie ma wśród świnek, są tylko źle wybarwione himalaye (słowo “źle” nie zostało tu użyte w znaczeniu pejoratywnym – owe źle wybarwione świnki mają swoje miejsce w każdym chyba standardzie). Geny grupy B odpowiadają za zawartość barwnika w skórze. Świnki BB ee caca, czyli posiadające czarny pigment, tworzą umaszczenie białe, zaś bb ee caca – umaszczenie albinos. Różnica polega na tym, że w pierwszym przypadku BB determinuje obecność ciemnego pigmentu w skórze (stąd charakterystyczne ciemne obwódki wokół oczu takich świnek), zaś bb sprawia, że skóra pigmentu jest pozbawiona.
Poruszając się dalej po palecie czerwonych kolorów natrafiamy na tezę, że gen C determinuje zarówno barwę czerwoną, jak i złotą. Jaka jest zatem różnica między nimi? Otóż barwę czerwoną otrzymujemy w przypadku BB (maksymalne nasycenie), zaś złotą w przypadku bb. Złoty ciemnooki ma PP lub Pp, zaś złoty czerwonooki pp. Dodatkowo złoty jest barwą charakteryzującą się większym rozświetleniem i żółtym odcieniem, co jest powodowane niepoznanymi jeszcze dokładnie genami, zwanymi “wzmacniaczami żółtego”, od niemieckiego Gelbverstärker. Powodują one, że maść świnki nie jest wyblakło czerwona, a intensywnie miedziano-złota.
Podobnie jedna kombinacja – cdcd – determinuje zarówno umaszczenie buff jak i szafran, które różnią się tym, że szafran posiada “wzmacniacze żółtego”, które nadają mu barwę świetlistej żółcieni. Szafrany w przeciwieństwie do buffów posiadają też geny pp, czyli mają czerwone oczy. Buffy z “wzmacniaczami żółtego” nie są uznane w żadnym standardzie. Różnicę daje się łatwo wyłapać gołym okiem i wybiera się do hodowli zwierzęta, które owe geny posiadają lub nie – w zależności od tego, co chcemy uzyskać.
Gen cd może również powodować powstanie oczu, które są ciemne, lecz pod pewnymi kątami padania światła widać w nich czerwone błyski.
Gen cr nazywany jest genem szynszylowym. Ma on tę ciekawą własność, że powoduje redukcję czerwonego pigmentu do białego, na czarny pigment wpływają przy tym nieznacznie, redukując go jedynie do sepii. Dodatkowo gen ten odpowiedzialny jest za powstawanie oczu niebieskich oraz tzw. oczu ognistych (ciemnoczerwonych). To właśnie ten gen warunkuje powstanie umaszczenia srebrny agouti o czarnych (sepia) końcówkach i nasadach oraz białych środkach włosa.
Krótkie pytanie testowe: jaki fenotyp odpowiada genotypowi BB epep Ss crcr? BB powoduje wytworzenie czarnego pigmentu, epep jego nierównomierne rozłożenie – szylkret. Dodatkowo kombinacja Ss wprowadza do 1/3 powierzchni ciała pokrytej białymi plamami (1/3 zamiast 1/2, bo mamy w sumie trzy barwy, a nie dwie). Świnka ma zatem umaszczenie szylkret z białym, czyli TSW: jest równomiernie pokryta plamami czarnymi, czerwonymi i białymi. Dodatkowo geny crcr powodują rozjaśnienie czerni do ciemnej sepii, zaś czerwieni do bieli! Mamy zatem świnkę, która jest w 1/3 ciemna sepia i w 2/3 biała. Jako, że umaszczenie to powstało poprzez geny epep, jest to wyjątkowo źle wybarwiony TSW. Tak oto przebrnęliśmy przez wszystkie informacje, które miałam do przekazania. Mam nadzieję, że udało mi się to zrobić w miarę przystępnie.
Autorem tekstu jest Pani Barbara Domagała (Sas), której serdecznie dziękujemy za udostępnienie cennych materiałów i zgodę na ich publikację.
